177Lu标记新型成纤维细胞活化蛋白抑制剂靶向治疗放射性碘难治性分化型甲状腺癌的初步研究
摘要
背景:这项探索性研究旨在评估一种基于成纤维细胞活化蛋白抑制剂的新型靶向治疗方法,对使用酪氨酸激酶抑制剂治疗出现进展的放射性碘难治的分化甲状腺癌(RR-DTC)患者的临床有效性和安全性。
方法:前瞻性招募接受索拉非尼/仑伐替尼治疗进展的转移性RR-DTC患者。如果患者在[68Ga]Ga-DOTA.SA.FAPi PET/CT显像上显示病灶有中至高度的摄取,并且患者已给予知情同意。患者接受每8周一次的[177Lu]Lu-DOTAGA.(SA.FAPi)2静脉注射治疗。主要终点是甲状腺球蛋白(Tg)水平变化和功能成像反应。次要终点为视觉模拟评分(VAS)和东部合作肿瘤组(ECOG)表现状态评分。毒性分级采用通用不良事件术语标准(CTCAEV5.0)进行。序列图像由双头伽玛相机获取,剂量计算采用OLINDA/EXM V2.1软件分析。
结果:共招募15例患者纳入治疗(平均年龄55 ± 9岁(范围39-67岁))。[177Lu]Lu-DOTAGA.(SA.FAPi)2全身中位有效半衰期为88.06小时(IQR: 86.6-99)。结肠被认为是一个关键性的器官。全身有效为1.62E-01 ± 1.53E-02mSV/MBq。一共给药45个周期,中位累积给药活性为8.2 ±2.7 GBq(范围5.5-14 GBq)。肿瘤病灶的中位吸收剂量为每周期1.08E+01 (IQR: 4.16E+00 ~ 8.97E+01) mSv/MBq。治疗后血清Tg水平显著下降,从治疗前的中位Tg水平10,549ng/mL (IQR: 30665 - 39,450)下降到5649ng/mL(IQR: 939.5-17,099),p=0.0005。分子影像评估显示无患者达到完全缓解CR标准,但是有4例患者达到部分缓解PR,3例患者提示病情稳定SD。VASmax评分从治疗前9分(IQR: 8-10)下降到随访后6分(IQR: 3-6),p-0.0001;ECOG评分从治疗前3分(IQR: 2 - 3 )下降到2分 (IQR: 2 - 3), p-0.0078。所有患者均未出现III/IV级血液学、肾脏或肝脏毒性。
结论:这些初步数据表明,[177Lu]Lu-DOTAGA.(SA.FAPi)2治疗重度晚期RAIR-DTC是安全的,似乎是有效性,为已经用尽所有标准治疗方法的侵袭性RR-DTC患者开辟了一条新的治疗途径。
方法(部分)
患者资料
入组进行[177Lu]Lu-DOTAGA.(SA.FAPi)2治疗的标准包括,大于18周岁,组织学(组织病理学检查)证实为DTC,有既往放射治疗/分子或生化疾病进展的病历记录,并且诊断为RR-DTC,东部合作肿瘤组(ECOG)状态评分高达4分,[68Ga] Ga-DOTA.SA显示病灶有高FAPi表达。与相应[18F]F-FDG PET/CT扫描结果相比,在FAPi PET/CT扫描显示更多或相等数量的阳性病灶,并且所有患者签署了知情同意书。4周内接受过抗癌治疗的患者、孕妇或哺乳期妇女、Hb <9 g/dL、白细胞计数< 4.0×109/L、血小板计数 < 75,000 / mL、肝功能参数不合格、基线时血肌酐>1.2 mg/dL的患者均被排除。最初,共19名患者接受了[68Ga]Ga-DOTA.SA.FAPi和[18F]F-FDG PET/CT扫描,排除了4例,其中2例在[68Ga]Ga-DOTA.SA.FAPi显示病灶较[18F]F-FDG少,其余2例显示轻度FAPi表达 (图1)。最后,我们的实验纳入了15名符合条件的晚期RR-DTC患者,他们服用MKIs后进展,这些患者接受了[177Lu]Lu-DOTAGA.(SA.FAPi)2治疗。患者于2020年10月至2021年9月4日进行随访,中位随访时间为7.2个月(IQR: 6.3-8.1个月)。其中3例患者(第1、4、7号患者)在第一个治疗周期参加了药物剂量学研究。治疗方案图1以流程图的形式详细描述了患者的招募和治疗方案。[177Lu]-DOTAGA.(SA.FAPi)2 使用30 mL 0.9%生理盐水稀释,静脉注射10分钟以上,随后使用10 mL生理盐水冲洗管路。患者以住院形式治疗,观察数小时无不良反应即可出院。在研究的后期阶段了解了[177Lu]Lu-DOTAGA.(SA.FAPi)2生物分布和药代动力学之后,在治疗前72小时,嘱患者食用高脂肪食物和泻药糖浆,以增加放射性示踪剂的肝肠排泄。
剂量测定方案
简而言之,使用双头伽玛相机(Discovery NM/CT 670; GE)进行治疗后全身SPECT扫描(PTxWBS)。该机配备了高能通用平行孔准直器,能量峰值分别在113 keV和208 keV,窗宽为10%。分别在注射后1小时(排尿前)、4-6小时、24小时、48小时、96小时和144-168小时对3例患者进行连续的PTx-WBS前后扫描,其余扫描在注射后24 - 48小时进行。同样,对腹部和病变部位进行SPECT/CT扫描。SPECT/CT的采集参数包括总角范围360°,角度为6,25秒/帧,矩阵大小为512×512。对于肿瘤剂量测定,采用了OLINDA/EXM v2.1软件中的球体模型。对于每个考虑在内的病变,治疗前[68Ga]Ga-DOTA.SA .FAPi PET/CT显像对病灶体积和PTx SPECT-CT对治疗后感兴面积使用商用工作站(GE Xeleris)进行。对于肿瘤吸收剂量的估计,基于医学内照射剂量公式的剂量方程
随访
每月根据体格检查和实验室检查(包括全血计数、肾功能、肝功能、血清促甲状腺素、甲状腺素和甲状腺球蛋白)进行安全性评估。建议患者填写受试者日记,记录疼痛评分和AE(不良事件),并每周进行回顾。中期[68Ga]Ga-DOTA.SA.FAPi扫描在2-3个周期治疗后的6-8周进行,并由同一个核医学医师评估。
疗效评估
主要终点是通过血清Tg水平测定和[68Ga]Ga-DOTA.SA.FAPi PET / CT扫描进行生化和功能成像反应评估截至2021年9月4日,根据临床设定标准将患者的反应分为完全缓解(CR)、部分缓解(PR)、持续性疾病和疾病进展。CR定义为影像学阴性,nsTg <0.1或sTg < 1 ng /mL,结构和功能影像表现阴性。PR定义为nsTg或sTg水平持续下降,或伴有PET/CT结构或功能成像好转。病灶增大或新病灶的出现,nsTg或sTg值有上升趋势,被归类为疾病进展。次要终点。根据其他临床反应评估参数评估,包括视觉模拟评分、镇痛评分、整体疼痛评估(GPA)、ECOG表现状态和不良事件情况。安全评估。根据美国国家癌症研究所的不良事件通用术语标准(NCI- CTCAE) 5.0版本,通过剂量学和AEs分级评估安全性。
结果(部分)
肿瘤和器官的辐射测定
平均器官和肿瘤吸收剂量列于表4和表5。在肝脏、胆囊、结肠、胰腺、肾脏、膀胱、泪腺、口腔黏膜和唾液腺均存在生理性摄取(图2和图3),全身有效剂量是1.62E-01 ± 1.53E-02,观察到的最高辐射剂量器官是结肠(左半结肠:1.97E+00 ± 1.68E-01 mSv/MBq,右半结肠:7.56E-01 ± 1.15E-01 mSv/MBq)。胰腺、胆囊、肾脏、肝脏和唾液腺有效剂量分别为7.20E-01± 6.41E-02、7.09E-01 ± 1.12E-01、3.02E-01 ± 2.86E-01、2.11E-01 ± 3.24E-02和1.11E-01 ± 2.52E-03mSv/MBq。[177Lu]Lu-DOTAGA.(SA.FAPi)2有比较长的全身有效半衰期,中位数为88.06小时(IQR: 86.6-99)。肿瘤病灶的中位吸收剂量为每周期1.08E+01 (IQR: 4.16E+00 ~ 8.97E+01) mSv/MBq。
反应评估
生化和功能成像反应。在评估时(2021年9月4日),所有患者的Tg水平相对治疗前均有下降,治疗前Tg中位水平:10,549 ng/mL (IQR: 3066.5 - 39450),评估时Tg中位水平:5649 ng/mL (IQR: 939.5-17,099),p = 0.0005。本研究中没有患者达到CR标准。所有患者Tg水平的持续下降表明均出现了生化反应。在接受间期[68Ga]Ga-DOTA.SA.FAPi PET/CT扫描的七名患者中,2例患者(5号和11号患者)属于非Tg分泌型患者,扫描结果分别提示PR和疾病稳定状态(SD)。在其余5例患者中,有3例患者均获得生化和分子反应(表3、图2和补充图S1),另有2例患者Tg水平显著下降,但在分子影像学评估中提示SD(表3、6)。1例非分泌型Tg患者(3号)在接受2个周期后拒绝治疗,但随访时出现新的颈部淋巴结,触诊坚硬,无发热症状,因此被归类为临床进展。患者2和3仍活着,但他们中止了进一步治疗(表3)。
临床反应评估
临床反应评估。VASmax和GPA反应标准得出的结果完全一致,CR为23% (3/13),PR为38.4%(5/13),最低反应为30.7%(4/13),1例患者(患者2)无反应,总反应率为92%(表7)。在中位随访7.2个月的情况下,VASmax评分从治疗前9分 (IQR: 8-10) 下降到随访时6 分(3 - 6),p- 0.0001。ECOG表现状态从治疗前3分(IQR: 2 – 3)下降到2分(IQR: 2 – 3),p- 0.0078。与VASmax和GPA分数一致,各反应组镇痛药的摄入量均下降(表7)。
病例展示:
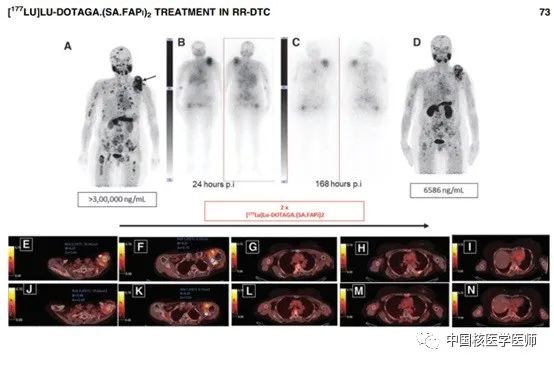
上图展示了一名滤泡型乳头状癌且TKIs治疗进展的50岁女性RR-DTC患者接受两个周期[177Lu]Lu-DOTAGA.(SA.FAPi)2治疗前后的图像。A图为治疗前[68Ga] FAPi显像的MIP图。B、C图展示患者静脉注射40mCi药物后24h和168h的全身SPECT图像,在第168h,主要病灶还存在放射性摄取。D图为两个周期治疗后的[68Ga] FAPi显像。E-N为治疗前(E-I)和治疗后(J-N)主要病灶的PET/CT融合图像。
如图所示,放射性示踪剂[68Ga] Ga-DOTA.SA.FAPi在转移病灶明显浓聚,同时口腔粘膜、唾液腺、肝脏、胰腺、胆囊、结肠和肾脏存在一定的生理性摄取。使用[177Lu]Lu-DOTAGA.(SA.FAPi)2治疗后直到第168h仍可见主要病灶的放射性浓聚。患者治疗前后出现了明显的分子反应,PET/CT显示主要病灶的大小和SUVmax都有减小和降低,患者的Tg水平也从>300000 ng/mL下降到6586,达到了显著的生化反应;该患者治疗前后VASmax评分也从10分下降到4分,临床症状得到明显的缓解。